- 予防医学の研究と実践に必須の理論と方法を提供する
- 臨床医学が個人を対象とするのに対して,疫学は集団を対象とする
- 病気のリスク要因を明らかにする,ほぼ唯一の科学的手段
- 嶋康晃. 世界の心臓を救った町―フラミンガム研究の55年. ライフサイエンス出版. 2004
- DAWBER TR, MOORE FE, MANN GV. Coronary heart disease in the Framingham study. Am J Public Health.1957; 47: 4-24.
- DAWBER TR, KANNEL WB, REVOTSKIE N, STOKES J, KAGAN A, GORDON T. Some factors associated with the development of coronary heart disease: Six years' follow-up experience in the Framingham study. Am J Public Health.1959; 49: 1349-56.
- Kannel WB, Eaker ED. Psychosocial and other features of coronary heart disease: Insights from the Framingham Study. Am Heart J. 1986; 112: 1066-73.
- 疾病分類の明確化:「病気」を明確に症例定義するには,共通の分類基準が必要。
- 調査対象または調査資料の選択:どういうデータを使うか?
- 調査すべき疾病量の把握:集団における疾病罹患状況を示す指標の性質を把握する。
- 調査方法の選択:記述疫学か分析疫学か介入研究か?
- 調査の実施と結果の分析:基本的に統計学を利用する。
- 結果の解釈と評価:因果関係(後述)の判断は難しい。
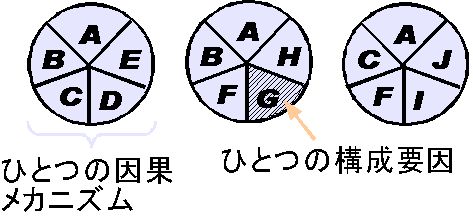
- 三角形モデル(epidemiologic triangle):宿主要因と環境要因と病因にわけて考える。
- 車輪モデル(wheel model):病因は宿主要因か環境要因から抜き出されたものなので別扱いせず,宿主要因を環境要因が取り巻いているものとして疾病の成り立ちを把握するモデル
- 因果の織物モデル(web of causation model):宿主要因と環境要因は複雑に絡み合っていることから,車輪よりも網の目として捉えるモデル
- 母集団が小さいときは,単純無作為抽出か層別抽出
- 母集団が大きいときは,資金が豊富にあれば層別抽出
- 母集団が大きく資金が乏しいとかアクセスが悪いときは多段抽出
- 信頼性(reliability):再現可能か?
- 妥当性(validity):測りたいものが測れているか?
- 正確さ(accuracy):真の値とずれていないか?
- 精度(precision):どこまで厳密か?
| 病気あり | 病気なし | |
|---|---|---|
| 曝露あり | a人 | b人 |
| 曝露なし | c人 | d人 |
この場合,オッズ比はad/bcとなる。もしこれがコホート研究で,最初に曝露ありの人がn1人,曝露なしの人がn2人いて,観察期間中に曝露ありの人のうちa人,曝露なしの人のうちc人が発症したならば,相対危険(a/n1)/(c/n2)や過剰危険(a/n1)-(c/n2)を求めることができるが,断面研究や症例対照研究ではn1,n2がわからないので相対危険や過剰危険を求めることができない。その場合でも要因への曝露の影響を評価できる指標がオッズ比である。稀な疾病の場合に検出効率がよく有効。
| A群 | B群 | |||||
|---|---|---|---|---|---|---|
| Yの値 | X=1 | X=0 | 計 | X=1 | X=0 | 計 |
| (1)地域相関研究データ(A群とB群でY=1のオッズは同じに見える) | ||||||
| Y=1 | ? | ? | 560 | ? | ? | 560 |
| Y=0 | 60 | 40 | 100 | 40 | 60 | 100 |
| オッズ | ? | ? | 5.6 | ? | ? | 5.6 |
| (2)共変量Xで層別すると各層でA群がB群よりY=1のオッズが低い場合 | ||||||
| Y=1 | 420 | 140 | 560 | 320 | 240 | 560 |
| Y=0 | 60 | 40 | 100 | 40 | 60 | 100 |
| オッズ | 7.0 | 3.5 | 5.6 | 8.0 | 4.0 | 5.6 |
| (3)共変量Xで層別すると各層でA群がB群よりY=1のオッズが高い場合 | ||||||
| Y=1 | 240 | 320 | 560 | 140 | 420 | 560 |
| Y=0 | 60 | 40 | 100 | 40 | 60 | 100 |
| オッズ | 4.0 | 8.0 | 5.6 | 3.5 | 7.0 | 5.6 |
- 一要因→一疾病(もっとも単純)
- 一要因→多疾病(重金属中毒ではさまざまな症状がでる場合が多い)
- 多要因→一疾病(HCV関連肝臓がんなど)
- 多要因→多疾病(多くの慢性疾患)
- その病原体が当該感染症患者から分離される
- その病原体は他の疾病患者には見出されない
- 患者から分離培養された病原体が実験動物に同一疾患を発生させる
- 当該罹患動物から再び同一の病原体が分離される